Cuprins
- 🔬 Privire generală
- 🧪 Familia apatitelor: ce sunt și de ce contează
- 📐 Structura hydroxyapatitei și matematica formulei
- 🧬 Substituție carbonatată și apatitele biologice
- 🏗️ De la celula unitară la prismele de smalț
- 💧 Solubilitate, substituție și importanța fluorului
- 📝 Implicații practice și concluzii
- ❓ Întrebări frecvente
- ⚙️ Ce urmează și de ce merită să știi asta
🔬 Privire generală
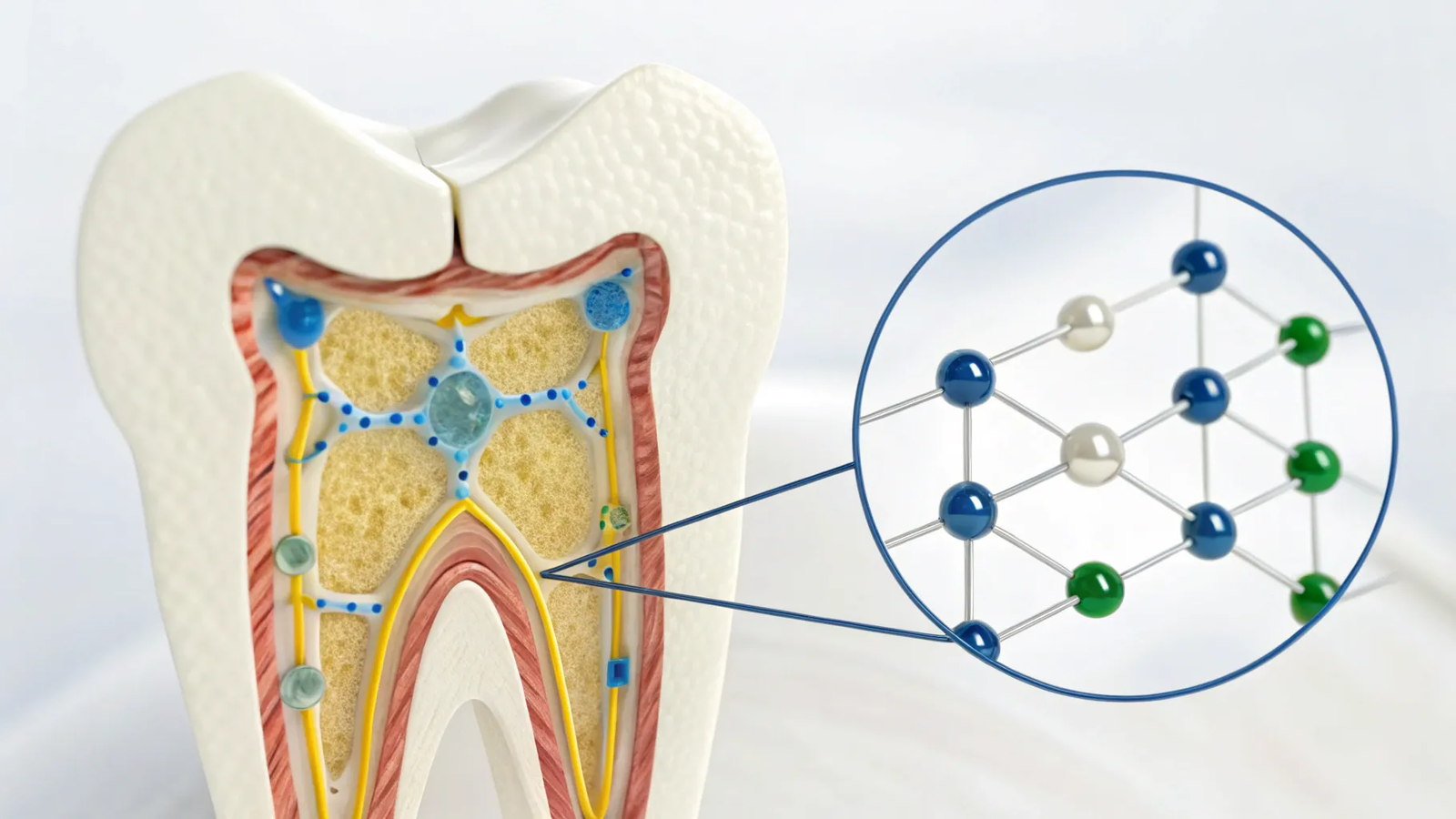
Îmi place să explic mecanica fină din spatele unor lucruri aparent simple, iar întrebarea „din ce este făcut un dinte” e un exemplu excelent. Surpriza majoră este că porțiunea exterioară a dintelui, smalțul, nu este alcătuită în mare parte din materiale organice, așa cum sunt cele mai multe țesuturi din corp. În schimb, smalțul este predominant mineral: aproximativ 85% hidroxiapatită prin volum și circa 95% prin greutate. Cu alte cuvinte, când ne întrebăm din ce este făcut un dinte, răspunsul este că imensa majoritate a structurii sale dure este o substanță minerală, nu una bazată pe carbon.
În această postare voi dezbate subiectul din ce este facut un dinte și ce înseamnă asta din punct de vedere chimic și structural, cum se aranjează atomii în cristalul care alcătuiește smalțul, ce modificări pot apărea și de ce toate acestea contează atunci când vorbim despre formarea cariilor.
🧪 Familia apatitelor: ce sunt și de ce contează
Termenul apatite nu se referă la foame, ci la o clasă de minerale care au aceeași formă cristalografică și aceeași bază chimică: fosfați de calciu. Sunt isomorfe, adică formele lor cristaline se păstrează chiar dacă anumite ioni sunt înlocuiți. Formula de bază pe care o întâlnim des în literatură este construită din 5 ioni Ca2+, 3 grupuri PO4 3- și un ion cu sarcină minus unu care poate fi OH-, F- sau Cl-. Dacă luăm calculul simplu, 5 Ca2+ dau +10, iar 3 PO4 3- dau -9, deci rămâne nevoie de un -1 pentru a echilibra sarcina. Acest -1 poate fi hidroxid, fluor sau clor.
Astfel apar denumirile:
- hydroxyapatite când X este OH-
- fluorapatite când X este F-
- chlorapatite când X este Cl-
Toate aceste variante pot exista ca minerale în natură, dar și ca componente biologice în dinți și oase, unde rolul substituțiilor are consecințe funcționale importante.
📐 Structura hydroxyapatitei și matematica formulei
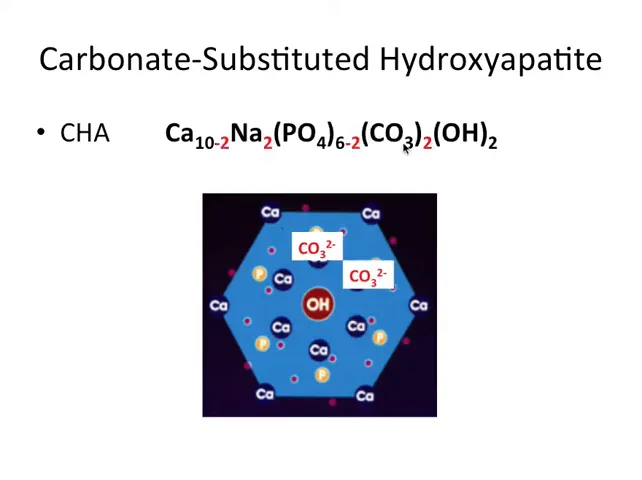
Literatura preferă să raporteze formula dublată: în loc de 5 Ca, 3 PO4 și 1 OH, se notează 10 Ca, 6 PO4 și 2 OH. Aceasta reflectă unitatea cristalină standard în studii. Structura este hexagonală și constituie un rețea rigidă de ioni de calciu și grupări fosfat, cu locuri libere care pot primi anioni precum OH-, F- sau CO3 2-.
Ca un mic exercițiu de chimie aplicată, dacă avem 10 Ca2+ avem +20, iar 6 PO4 3- dau -18. Atunci trebuie două sarcini negative suplimentare, pe care le aduc doi ioni OH- pentru a ajunge la echilibru. Acest echilibru ionic este esențial pentru stabilitatea cristalului.
🧬 Substituție carbonatată și apatitele biologice
Materialul care alcătuiește efectiv smalțul, dentina și oasele nu este hydroxyapatite pură. În corp se găsește o variantă modificată: carbonat substituted hydroxyapatite, adică hidroxiapatită în care unele grupări fosfat au fost înlocuite de grupări carbonate. Această substituție schimbă proprietățile cristalului: îl face mai asemănător cu mineralul biologic și crește solubilitatea.
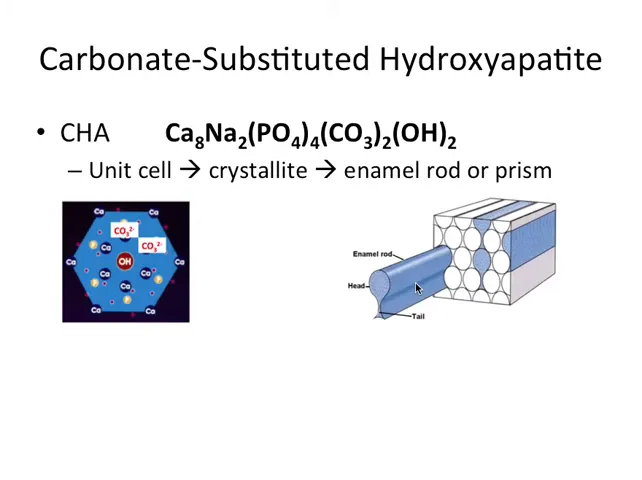
Procesul este următorul în termeni simpli: dacă înlocuim X grupări fosfat cu X grupări carbonate, scad și X număr de ioni calciu pentru a păstra neutralitatea, iar în același timp apar ioni de sodiu pentru echilibrare. Astfel apare o formulă ajustată care păstrează sarcina neutra la nivel molecular. Motivația biologică e clară: structura trebuie să fie suficient de reactivă pentru procesele de remodelare și pentru procesele de mineralizare și remineralizare care au loc la suprafața dinților.
🏗️ De la celula unitară la prismele de smalț
Un lucru fascinant este cum se construiesc macroscopic aceste minerale. Unit cell sau celula unitară este forma de bază, un mic hexagon pe care îl repetăm. Când stivuim aceste celule obținem un crystallite, iar când stivuirea și orientarea continuă apar structuri mai mari, precum prismele de smalț sau “enamel rods”, care au o formă asemănătoare cu o cheie sau un ochi de cheie.
Formarea acestor prisme are loc în timpul amelogenezei, sub coordonarea ameloblastei, celule epiteliale specializate care secretă matricea și favorizează nuclearea cristalelor. Felul în care aceste prisme sunt orientate determină, în final, proprietățile mecanice și optice ale smalțului.
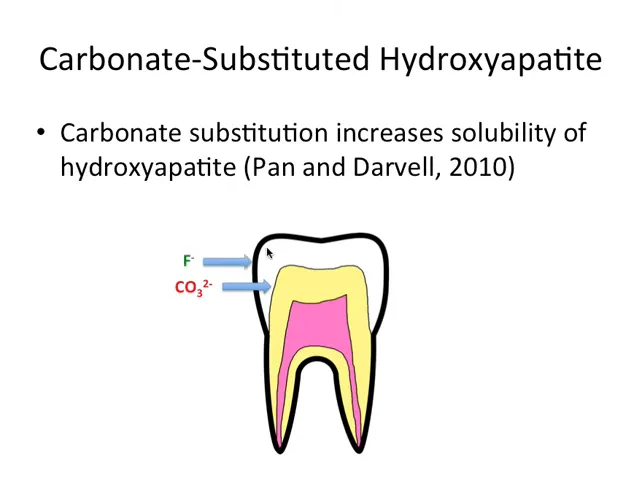
💧 Solubilitate, substituție și importanța fluorului
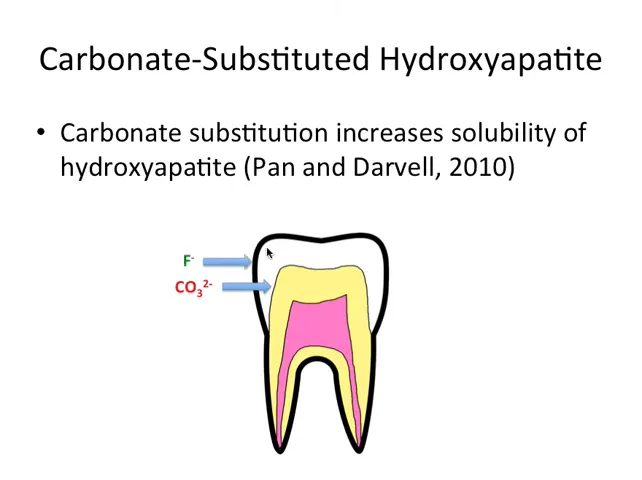
Un punct cheie pe care vreau să îl subliniez este că substituția carbonatului crește solubilitatea hidroxiapatitei. Ce înseamnă asta în practică? Că porțiunile din smalț cu mai mult carbonat se dizolvă mai ușor în condiții acide. Din păcate pentru dinte, acizi produse de bacteriile din placă sau băuturile acide pot declanșa pierderea de minerale acolo unde smalțul este mai solubil.
Compoziția smalțului nu este uniformă de la exterior spre interior. În mod tipic, porțiunea exterioară a smalțului tinde să fie mai bogată în fluorapatite, adică înlocuirea OH- cu F- reduce solubilitatea. Aceasta este o parte din motivul pentru care fluorul din apă, paste de dinți sau apa fluorurată joacă un rol protector. Fluorul “bănuiește” smalțul de la suprafață și reduce tendința acestuia de a se dizolva în medii acide.
Așadar, nu toate zonele smalțului sunt la fel: zona de lângă joncțiunea smalț-dentină are, de regulă, mai mult carbonat și este mai solubilă. De aici urmează una dintre concluziile practice cele mai importante: cu cât leziunea cariilor pătrunde mai adânc, cu atât țesutul este mai susceptibil la dizolvare.
📝 Implicații practice și concluzii
Ce înseamnă toate aceste detalii pentru viața de zi cu zi? În termeni simpli:
- Smalțul este în mare parte un mineral asemănător hydroxyapatitei, dar modificat prin substituții.
- Substituția cu carbonat face smalțul mai solubil, deci mai vulnerabil la acizi.
- Prezența fluorului tinde să inverseze parțial această vulnerabilitate prin formarea de fluorapatite mai rezistente.
- Proximitatea la dentină înseamnă, de regulă, mai mult carbonat și o solubilitate mai mare, motiv pentru care cariile profunde se pot răspândi rapid.
Pe baza acestor fapte, strategiile eficiente pentru prevenirea cariilor devin evidente: limitarea expunerii la acizi, controlul plăcii bacteriene, utilizarea fluorului pentru a întări suprafața externă a smalțului și timpul adecvat pentru periaj și aplicarea fluorurilor. De asemenea, înțelegerea structurii cristaline explică de ce anumite materiale folosite în implantologie sau restaurări dentare încearcă să imite hydroxyapatita carbonatată pentru a se integra mai bine biologic.
❓ Întrebări frecvente referitor la: din ce este facut un dinte
Ce este exact hydroxyapatita?
Hydroxyapatita este un mineral de fosfat de calciu cu formula de bază care include ioni Ca2+, grupări PO4 3- și ioni OH-. În formă pură apare ca un pulbere alb, dar în context biologic este adesea modificată prin substituții cu carbonate sau fluori.
De ce sunt dinții considerați anorganici?
Pentru că structura majoritară a smalțului și o parte mare a dentinei este alcătuită din minerale (fosfați de calciu) care nu sunt bogate în carbon organic, spre deosebire de alte țesuturi ale corpului care sunt alcătuite din proteine, lipide și alte molecule organice.
Ce face substituția carbonatului în smalț?
Introducerea grupărilor carbonate în locul unor grupări fosfat crește solubilitatea cristalului, ceea ce înseamnă o susceptibilitate mai mare la dizolvarea în medii acide. Aceasta este caracteristica smalțului biologic comparativ cu hydroxyapatita pură.
De ce este important fluorul?
Ionul fluor înlocuiește OH- în structura apatitei și formează fluorapatita, care este mai puțin solubilă în acid decât hydroxyapatita. De aceea aplicarea locală sau aportul optim de fluor reduce riscul de carii prin întărirea stratului extern al smalțului.
Se poate remineraliza smalțul pierdut?
Da, în fazele inițiale de demineralizare reversibilă se poate produce remineralizare prin aport de ioni calciu, fosfat și fluor, mai ales dacă mediul bucal nu rămâne acid și sunt aplicate practici igienice și fluoruri adecvate. Leziunile cavitare avansate necesită intervenții restaurative.
De ce cariile devin mai problematice când ajung la dentină?
Dentina are, în general, o compoziție mai bogată în substituții carbonatate și o structură mai poroasă decât smalțul, ceea ce o face mai solubilă și mai ușor afectată de medii acide. De aceea leziunile care trec din smalț în dentină progresează de obicei mai rapid.
⚙️ Ce urmează și de ce merită să știi asta
Îmi place să conectez detaliile chimice cu deciziile practice. Când știi că smalțul este un cristal sensibil la compoziția ionică din jurul său, înțelegi de ce scăderea frecventă a pH-ului oral, consumul de băuturi acide și lipsa fluorului sau a îngrijirii orale permit cariilor să înceapă și să progreseze. În plus, explică de ce tratamentele preventive se concentrează pe modificarea mediu-lui bucal și pe consolidarea chimică a smalțului.
Aceste fundamente științifice pot părea tehnice, dar ele ne oferă un ghid clar pentru prevenție și pentru înțelegerea modului în care intervențiile cum ar fi fluorizarea, aplicarea cuvar și igiena orală funcționează la nivel molecular. Eu voi continua să detaliez echilibrul dintre mineral din dinte și mineral din cavitatea bucală și cele trei componente majore necesare pentru formarea cariilor, astfel încât să poți lua decizii informate despre sănătatea ta dentară.
Acest articol a fost creat dupa video What Is A Tooth Made Out Of? cu ajutorul AI.